Bộ Y tế gia hạn Giấy đăng ký lưu hành tại Việt Nam với 1.017 loại thuốc sản xuất trong nước
Căn cứ Luật Dược số 105/2016/QH13 ngày 06/4/2016; Căn cứ Nghị định số 95/2022/NĐ-CP ngày 15/11/2022 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế; Căn cứ Quyết định số 1969/QĐ-BYT ngày 26/4/2023 của Bộ trưởng Bộ Y tế quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế; Căn cứ Thông tư số 08/2022/TT-BYT ngày 05/09/2022 của Bộ trưởng Bộ Y tế quy định việc đăng ký lưu hành thuốc, nguyên liệu làm thuốc; Căn cứ kết luận của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc - Bộ Y tế; Theo đề nghị của Trưởng phòng Đăng ký thuốc, Cục Quản lý Dược.
Quyết định:
Điều 1. Ban hành kèm theo Quyết định này danh mục 1017 thuốc sản xuất trong nước được cấp giấy đăng ký lưu hành tại Việt Nam - Đợt 187, cụ thể:


1. Danh mục 918 thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành hiệu lực 05 năm (Phụ lục I kèm theo).
2. Danh mục 99 thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành hiệu lực 03 năm (Phụ lục II kèm theo).
Điều 2. Cơ sở sản xuất và cơ sở đăng ký thuốc có trách nhiệm:
1. Sản xuất thuốc theo đúng các hồ sơ, tài liệu đã đăng ký với Bộ Y tế và phải in số đăng ký được Bộ Y tế Việt Nam cấp lên nhãn thuốc.
2. Chỉ được sản xuất, đưa ra lưu hành các thuốc kiểm soát đặc biệt khi có Giấy chứng nhận đủ điều kiện kinh doanh dược phạm vi kinh doanh thuốc phải kiểm soát đặc biệt phù hợp với phạm vi hoạt động của cơ sở đáp ứng quy định tại khoản 5 Điều 143 Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược.
3. Thực hiện việc cập nhật tiêu chuẩn chất lượng của thuốc theo quy định tại Thông tư số 11/2018/TT-BYT ngày 04/5/2018 của Bộ trưởng Bộ Y tế quy định về chất lượng thuốc, nguyên liệu làm thuốc.
4. Thực hiện, phối hợp với cơ sở nhập khẩu thực hiện theo đúng quy định tại Công văn số 5853/QLD-CL ngày 19/4/2019 của Cục Quản lý Dược về việc kiểm tra chất lượng nguyên liệu làm thuốc nhóm sartan đối với các thuốc thuộc danh mục tại Điều 1 ban hành kèm theo Quyết định này có chứa dược chất thuộc nhóm sartan
5. Thuốc được gia hạn giấy đăng ký lưu hành tại Quyết định này nhưng chưa nộp hồ sơ cập nhật nội dung nhãn thuốc, tờ hướng dẫn sử dụng thuốc theo quy định của Thông tư 01/2018/TT-BYT ngày 18/01/2018 của Bộ trưởng Bộ Y tế thì phải thực hiện cập nhật theo quy định tại điểm b Khoản 1 Điều 37 Thông tư số 01/2018/TT-BYT trong thời hạn 12 tháng kể từ ngày được gia hạn giấy đăng ký lưu hành.
6. Sau 12 tháng kể từ ngày ký ban hành Quyết định này, các thuốc được gia hạn giấy đăng ký lưu hành theo Quyết định này có thay đổi về nội dung hành chính (bao gồm cả mẫu nhãn và tờ hướng dẫn sử dụng thuốc) phải sản xuất và lưu hành với các nội dung đã được phê duyệt thay đổi trong hồ sơ gia hạn.
7. Cơ sở đăng ký thuốc phải bảo đảm duy trì điều kiện hoạt động trong thời gian hiệu lực của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc. Trong trường hợp không còn đáp ứng đủ điều kiện hoạt động, cơ sở đăng ký phải có trách nhiệm thực hiện thay đổi cơ sở đăng ký theo quy định tại Thông tư số 08/2022/TT-BYT trong thời hạn 30 ngày kể từ ngày cơ sở đăng ký không còn đủ điều kiện hoạt động.
8. Cơ sở sản xuất thuốc phải bảo đảm các điều kiện hoạt động của cơ sở sản xuất trong thời hạn hiệu lực của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
9. Các thuốc được gia hạn giấy đăng ký lưu hành tại Quyết định này được tiếp tục sử dụng số đăng ký đã cấp trước khi gia hạn trong thời hạn tối đa 12 tháng kể từ ngày được cấp số đăng ký gia hạn theo quy định tại Phụ lục VI ban hành kèm theo Thông tư số 08/2022/TT-BYT.
Điều 3. Quyết định này có hiệu lực kể từ ngày ký ban hành.
Điều 4. Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương và Giám đốc cơ sở sản xuất và cơ sở đăng ký có thuốc tại Điều 1 chịu trách nhiệm thi hành Quyết định này.
Thu Hằng
- Sản phẩm vì sức khỏe
-
Xác thực truy xuất nguồn gốc - 'thuốc đặc trị' chống hàng giả
Khi nền kinh tế số đang trở thành một trong những trụ cột phát triển của đất nước, thì yêu cầu về tính xác thực, minh bạch và khả năng truy xuất nguồn gốc của hàng hóa không chỉ phục vụ công tác quản lý nhà nước mà còn là điều kiện tiên quyết để nâng cao niềm tin thị trường trong nước và hội nhập quốc tế.July 9 at 8:25 am -
Công tác đánh giá, phân hạng sản phẩm OCOP được chia thành 02 cấp
Phó Thủ tướng Trần Hồng Hà ký Quyết định số 1489/QĐ-TTg ngày 6/7/2025 sửa đổi, bổ sung một số nội dung Quyết định số 148/QĐ-TTg về việc phê duyệt Bộ tiêu chí và quy trình đánh giá, phân hạng sản phẩm Chương trình mỗi xã một sản phẩm (OCOP).July 7 at 7:32 am -
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 3 at 12:01 pm -
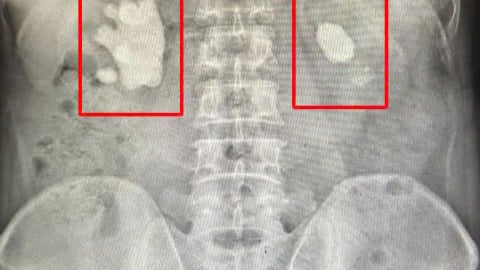
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am




 Từ khóa:
Từ khóa: