Bộ Y tế họp khẩn về tiến độ và kế hoạch thử nghiệm vaccine Nano Covax
Sáng 25/6, cuộc họp khẩn được triệu tập do lãnh đạo Cục Khoa học công nghệ và Đào tạo, Bộ Y tế và Hội đồng Đạo đức nghiên cứu y sinh học quốc gia chủ trì. Các thành viên của tiểu ban vaccine và chuyên gia, thành viên nhóm nghiên cứu của Học viện Quân y, Viện Pasteur TP.HCM, Công ty Nanogen tham dự. Điểm Viện Pasteur TP.HCM và công ty Nanogen sẽ tham gia họp trực tuyến.
Tại cuộc họp này, Bộ Y tế và chuyên gia sẽ nghe báo cáo, đánh giá tiến độ, kết quả triển khai thử nghiệm lâm sàng giai đoạn 3 vaccine ngừa COVID-19 Nano Covax tính đến ngày 25/6 và xem xét mở rộng địa điểm nghiên cứu thử nghiệm lâm sàng giai đoạn 3 vaccine Nano Covax.
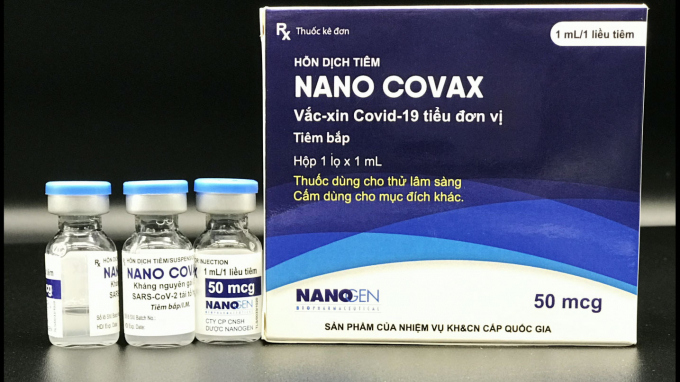
Trước đó, ngày 15/6, Công ty Nanogen đã có kiến nghị gửi Thủ tướng mong muốn sớm cấp phép khẩn cấp có điều kiện cho vaccine Nano Covax tương tự như các vaccine của Nga, Trung Quốc, Ấn Độ.
Nanogen cho biết dựa trên các kết quả thử nghiệm lâm sàng, khả năng sinh miễn dịch của vaccine Nano Covax đạt 99,4%, tương đương các vaccine khác trên thế giới và có phần cao hơn. Giá bán dự kiến của Nano Covax chỉ khoảng 120.000 đồng/liều.
Tuy nhiên ngay sau đó lãnh đạo Cục Khoa học công nghệ và Đào tạo, Bộ Y tế đã có phản hồi, cho rằng kiến nghị của Nanogen là nóng vội, số lượng 1.000 mẫu thử nghiệm giai đoạn 3 chưa nói lên được gì nhiều, các dữ liệu cần tiếp tục thu thập, nghiên cứu.
Trong trường hợp chưa đủ dữ liệu, Bộ Y tế ưu tiên sử dụng các loại vaccine đã được thử nghiệm 3 giai đoạn và được WHO phê duyệt như AstraZenenca, Sputnik V, Pfizer…
Bộ Y tế khẳng định việc đưa một vaccine tiêm rộng rãi cho người dân cần phải rất cẩn trọng, phải có đữ dữ liệu khoa học. Việc phê duyệt cấp phép thận trọng không phải để làm khó doanh nghiệp.
Ngày 23/6, phía Công ty Nanogen tiếp tục có phản biện cho rằng các kiến nghị không nóng vội, vaccine của Nga, Ấn Độ, Trung Quốc cũng được cấp phép khẩn cấp khi mới thử nghiệm giai đoạn 2. Do đó, việc Nanocovax thử nghiệm trên hơn 1.000 cho cả 3 giai đoạn đến nay là quá đủ.
Công ty này đặt vấn đề: "Tại sao phải chấp nhận xin vaccine từ nước ngoài, trong khi đất nước đang trong tình hình dịch căng thẳng, người dân nào cũng muốn được tiêm vaccine?". Công ty Nanogen khẳng định, công ty nghiên cứu và phát triển vaccine do nhà nước giao nhiệm vụ. Nếu được cấp phép, công ty sẽ tập trung sản xuất vaccine đảm bảo nhu cầu của người dân Việt Nam, không xuất khẩu.
Thiên Thư
- Sản phẩm vì sức khỏe
-
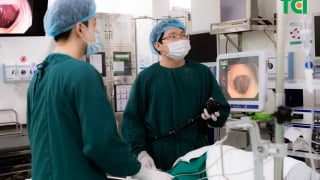
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am -
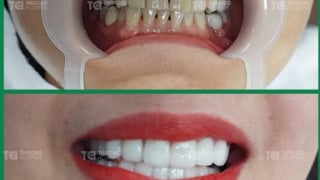
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 1 at 12:01 pm -
Chấm dứt ợ hơi, ợ chua, mất ngủ nhờ phương pháp đo áp lực thực quản HRM hiện đại
Từng khổ sở với ợ hơi, ợ chua, nuốt vướng và mất ngủ triền miên, chị H.T.B.L (38 tuổi) đã tìm lại giấc ngủ ngon và sức khỏe chỉ sau thời gian ngắn điều trị tại Bệnh viện Đa khoa Quốc tế Thu Cúc nhờ kỹ thuật đo áp lực và nhu động thực quản độ phân giải cao HRM.July 1 at 12:00 pm -
Long Châu hợp tác cùng Viện Kiểm nghiệm ATVSTP Quốc gia chủ động tiên phong tiến hành “kiểm tra kép vì sức khỏe người dân và khách hàng”
Trước thực trạng thuốc giả, thực phẩm chức năng giả làm ảnh hưởng nghiêm trọng đến niềm tin của người tiêu dùng và sức khỏe cộng đồng, hưởng ứng chủ trương của Chính phủ trong phòng chống hàng giả, hàng kém chất lượng, hệ thống nhà thuốc Long Châu chủ động tiên phong ký kết hợp tác chiến lược với Viện Kiểm nghiệm an toàn vệ sinh thực phẩm Quốc gia (Bộ Y tế).June 25 at 5:09 pm




 Từ khóa:
Từ khóa: