Bộ Y tế ngừng tiếp nhận hồ sơ đăng ký, gia hạn thuốc đối với Dược phẩm Me Di Sun
Theo Báo Sức khỏe Đời sống, Cục Quản lý Dược đã ngừng nhận hồ sơ đề nghị cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với các hồ sơ do Công ty Cổ phần Dược phẩm Me Di Sun sản xuất và/hoặc đứng tên đăng ký trong thời gian 12 tháng kể từ ngày 30/7. Nguyên nhân của quyết định kể trên, Cục cho biết, công ty Cổ phần Dược phẩm Me Di Sun đã sản xuất 2 lô thuốc vi phạm chất lượng mức độ 2.
Cục Quản lý Dược (Bộ Y tế) ngừng tiếp nhận hồ sơ đề nghị cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với Công ty Cổ phần Dược phẩm Me Di Sun do sản xuất 2 lô thuốc vi phạm chất lượng mức độ 2.
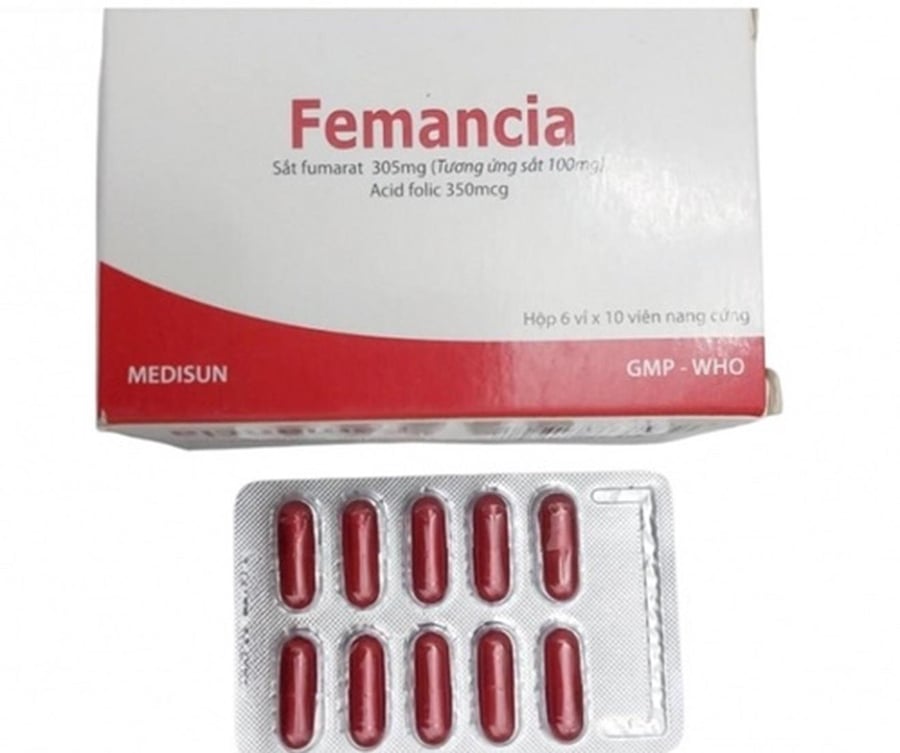
Trước đó, hồi tháng 3, Cục đã thông báo thu hồi hai lô thuốc viên nang cứng Femancia (số đăng ký VD-27929-17) của công ty này vì không đạt tiêu chuẩn chất lượng về định lượng và độ hòa tan. Đây là thuốc bổ sung sắt, được giới thiệu để ngăn ngừa thiếu máu và thiếu sắt, cũng do công ty trên đăng ký. Sau quyết định này, Femancia không được sản xuất và lưu hành trên thị trường. Công ty Cổ phần Dược phẩm Me Di Sun có trách nhiệm thu hồi toàn bộ số thuốc này.
Theo Vnexpress dẫn quy định của Luật Dược, một doanh nghiệp sẽ bị thu hồi giấy đăng ký lưu hành thuốc nếu có ít nhất hai lô sản phẩm bị thu hồi bắt buộc do vi phạm mức độ 2 trong vòng 5 năm kể từ ngày cấp phép. Vi phạm chất lượng mức độ 2 được định nghĩa là thuốc không đạt tiêu chuẩn ở các chỉ tiêu không định tính, không trực tiếp đe dọa nghiêm trọng đến sức khỏe hay tính mạng người dùng, nhưng có thể ảnh hưởng đến hiệu quả điều trị hoặc tiềm ẩn rủi ro khi sử dụng lâu dài, liều cao.
Theo Vietnamnet, mức độ vi phạm của thuốc được chia thành 3 mức, trong đó mức 1 là nghiêm trọng nhất. Thuốc vi phạm mức độ 2 là thuốc có bằng chứng về việc không bảo đảm đầy đủ hiệu quả điều trị hoặc có nguy cơ không an toàn cho người sử dụng nhưng chưa đến mức gây tổn hại nghiêm trọng đối với sức khỏe hoặc chưa ảnh hưởng đến tính mạng của người sử dụng.
Bộ Y tế cũng quy định 24 trường hợp thuốc vi phạm mức độ 2, ví dụ thuốc được sản xuất từ nguyên liệu không đạt tiêu chuẩn chất lượng; thuốc không có bằng chứng đã được kiểm tra chất lượng trong quá trình sản xuất và trước khi xuất xưởng; thuốc không có giấy đăng ký lưu hành hoặc chưa được phép nhập khẩu; Thuốc có hàm lượng nằm ngoài mức giới hạn 5% so với giới hạn quy định tại hồ sơ đăng ký.
Sau khi thời hạn 12 tháng ngừng tiếp nhận hồ sơ kết thúc, Công ty Cổ phần Dược phẩm Me Di Sun sẽ phải nộp lại hồ sơ theo đúng quy định nếu muốn tiếp tục đăng ký thuốc hoặc nguyên liệu làm thuốc.
Nguyên An (tổng hợp)
- Sản phẩm vì sức khỏe
-
Vitamin E và những tác dụng đối với buồng trứng
Vitamin E không chỉ dừng lại ở vai trò làm đẹp hay chống lão hóa mà còn duy trì hoạt động ổn định của buồng trứng và hỗ trợ khả năng sinh sản ở nữ giới.July 26 at 12:41 pm -
Vinmec tiên phong điều trị động kinh bằng Robot định vị thần kinh hàng đầu thế giới
Lần đầu tại Việt Nam, một ca động kinh kháng trị ở trẻ em được điều trị thành công bằng công nghệ robot định vị AutoGuide. Ca phẫu thuật do Bệnh viện Đa khoa Quốc tế Vinmec Central Park (TP.HCM) thực hiện đánh dấu bước đột phá trong điều trị bệnh lý thần kinh phức tạp, mở ra hy vọng cho hàng ngàn bệnh nhân động kinh tại Việt Nam.July 25 at 3:37 pm -
Phát hiện thêm công dụng mới trong thuốc điều trị ung thư của Singapore
Các nhà nghiên cứu Singapore phát hiện ra rằng một loại thuốc điều trị ung thư do nước này phát triển có thể trở thành thuốc điều trị mới cho 2 nguyên nhân gây mù lòa hàng đầu thế giới.July 16 at 8:04 am -
Thái Lan sản xuất thuốc điều trị ung thư nhắm đích đầu tiên được phát triển trong nước
Theo phóng viên TTXVN tại Bangkok, Thái Lan đã sản xuất thuốc viên điều trị ung thư nhắm đích đầu tiên – có tên Imcranib 100 - hoàn toàn được phát triển trong nước. Đây là kết quả của tầm nhìn khoa học và sự lãnh đạo của Công chúa hoàng gia Thái Lan - Giáo sư Tiến sĩ Chulabhorn Krom Phra Srisavangavadhana.July 15 at 9:13 am