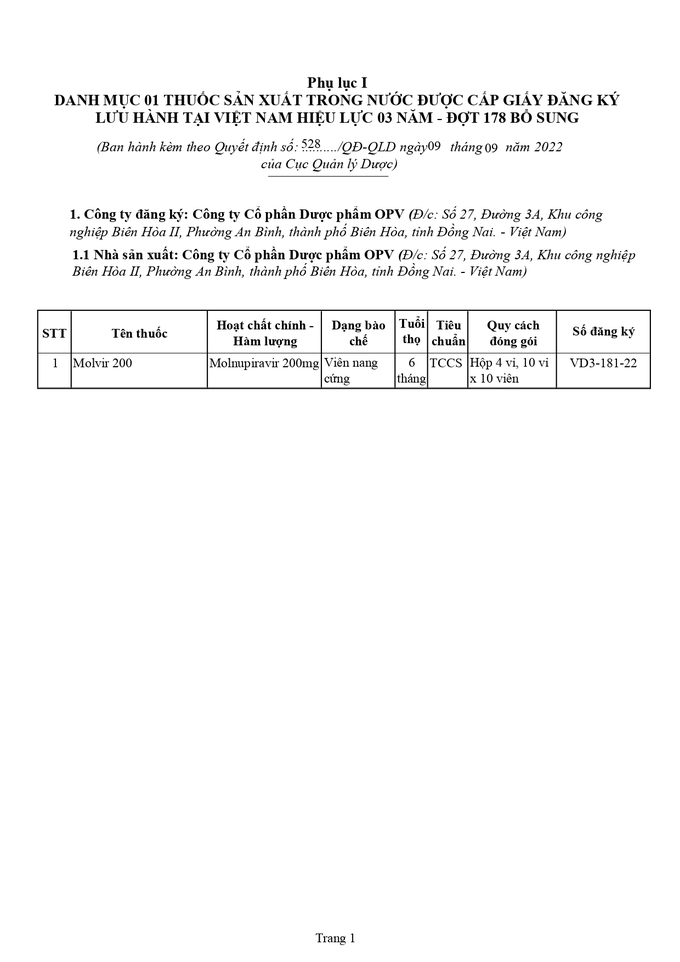
Danh mục 1 thuốc sản xuất trong nước được cấp giấy đăng ký lưu hành tại Việt Nam
Ngày 9/9, Cục Quản lý Dược (Bộ Y tế) Ban hành kèm theo Quyết định này danh mục 1 thuốc sản xuất trong nước được cấp giấy đăng ký lưu hành tại Việt Nam - Đợt 178 bổ sung (tại Phụ lục I đính kèm). Thuốc có số đăng ký với ký hiệu VD3-181-22 và có hiệu lực 03 năm kể từ ngày ký ban hành Quyết định này.
Cơ sở sản xuất và cơ sở đăng ký thuốc có trách nhiệm thực hiện các quy định tại Phụ lục II ban hành kèm theo Quyết định này, quy định tại Điều 3, 4 Thông tư số 32/2018/TT-BYT và các quy định sau:


- Sản xuất thuốc theo đúng các hồ sơ, tài liệu đã đăng ký với Bộ Y tế và phải in số đăng ký được Bộ Y tế cấp lên nhãn thuốc.
- Phối hợp với các cơ sở điều trị thực hiện đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc trên người Việt Nam và tổng hợp, báo cáo theo quy định tại Điều 5 Thông tư số 32/2018/TT-BYT.
Sở Y tế các tỉnh, thành phố trực thuộc Trung ương thông báo cho các cơ sở khám chữa bệnh, các cán bộ y tế, các cơ sở cung ứng thuốc trên địa bàn quản lý thực hiện:
- Thông báo cho bệnh nhân về các lợi ích, rủi ro khi sử dụng thuốc, các phương pháp điều trị, các thuốc khác có thể thay thế thuốc Molnupiravir trong điều trị COVID-19.
- Tăng cường theo dõi, giám sát, phát hiện, xử trí các trường hợp xảy ra phản ứng có hại của thuốc (nếu có) và gửi báo cáo phản ứng có hại của thuốc về: Trung tâm quốc gia về Thông tin thuốc và Theo dõi phản ứng có hại của thuốc (13-15 Lê Thánh Tông, Quận Hoàn Kiếm, Hà Nội) hoặc Trung tâm khu vực về thông tin thuốc và theo dõi phản ứng có hại của thuốc TP. Hồ Chí Minh (201B Nguyễn Chí Thanh, Quận 5, TP. Hồ Chí Minh) theo quy định.
Trung tâm DI&ADR Quốc gia - Trường Đại học Dược Hà Nội, Trung tâm khu vực về thông tin thuốc và theo dõi phản ứng có hại của thuốc TP. Hồ Chí Minh - Bệnh viện Chợ Rẫy, Trung tâm Dược lý lâm sàng - Trường Đại học Y Hà Nội có trách nhiệm theo dõi, cập nhật và báo cáo về Cục Quản lý Dược những thông tin sau:
- Thông tin trong tờ hướng dẫn sử dụng của thuốc chứa Molnupiravir được phê duyệt tại các quốc gia tham chiếu trên thế giới để cập nhật tờ hướng dẫn sử dụng chung thống nhất cho các thuốc molnupiravir.
- Thông tin liên quan an toàn, hiệu quả của thuốc chứa Molnupiravir được đánh giá bởi các cơ quan quản lý dược trên thế giới, Tổ chức Y tế thế giới (WHO) và thông tin về sử dụng, tình trạng lưu hành thuốc chứa Molnupiravir trên thế giới.
- Thông tin liên quan đến báo cáo ADR thuốc, các thông tin an toàn, hiệu quả thuốc lưu hành tại Việt Nam.
Trong quá trình lưu hành thuốc, căn cứ việc theo dõi, cập nhật thông tin về an toàn, hiệu quả của thuốc tại Việt Nam và trên thế giới, Cục Quản lý Dược báo cáo Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc - Bộ Y tế để quyết định thu hồi giấy đăng ký lưu hành đã cấp này theo quy định tại khoản 1 Điều 58 Luật Dược.
Cơ sở đăng ký phải thực hiện cập nhật tờ hướng dẫn sử dụng theo nội dung của tờ hướng dẫn sử dụng đã được Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc - Bộ Y tế phê duyệt được ban hành tại Phụ lục III kèm theo Quyết định này.
Nguyễn Trang
- Sản phẩm vì sức khỏe
-
Xác thực truy xuất nguồn gốc - 'thuốc đặc trị' chống hàng giả
Khi nền kinh tế số đang trở thành một trong những trụ cột phát triển của đất nước, thì yêu cầu về tính xác thực, minh bạch và khả năng truy xuất nguồn gốc của hàng hóa không chỉ phục vụ công tác quản lý nhà nước mà còn là điều kiện tiên quyết để nâng cao niềm tin thị trường trong nước và hội nhập quốc tế.July 9 at 8:25 am -
Công tác đánh giá, phân hạng sản phẩm OCOP được chia thành 02 cấp
Phó Thủ tướng Trần Hồng Hà ký Quyết định số 1489/QĐ-TTg ngày 6/7/2025 sửa đổi, bổ sung một số nội dung Quyết định số 148/QĐ-TTg về việc phê duyệt Bộ tiêu chí và quy trình đánh giá, phân hạng sản phẩm Chương trình mỗi xã một sản phẩm (OCOP).July 7 at 7:32 am -
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 3 at 12:01 pm -
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am




 Từ khóa:
Từ khóa: