Bộ Y tế cập nhật quy định về các chất sử dụng trong mỹ phẩm
Triển khai thực hiện Hiệp định Mỹ phẩm ASEAN và quy định tại Thông tư số 06/2011/TT-BYT ngày 25/01/2011 của Bộ trưởng Bộ Y tế quy định về quản lý mỹ phẩm, căn cứ kết quả các cuộc họp Hội đồng Mỹ phẩm ASEAN (ACC) lần thứ 38 và Hội đồng Khoa học mỹ phẩm ASEAN (ACSB) lần thứ 38, Cục Quản lý Dược thông báo đến các Đơn vị như sau:
1. Các Phụ lục (Annex) của Hiệp định Mỹ phẩm ASEAN bao gồm:
- Phụ lục II. Danh mục các chất không được phép sử dụng trong sản phẩm mỹ phẩm;
- Phụ lục III. Danh mục các chất có quy định giới hạn nồng độ, hàm lượng trong sản phẩm mỹ phẩm;
- Phụ lục IV. Các chất màu được phép dùng trong mỹ phẩm;
- Phụ lục VI. Danh mục các chất bảo quản được phép sử dụng trong sản phẩm mỹ phẩm;
- Phụ lục VII. Danh mục các chất lọc tia tử ngoại.
2. Thông tin cụ thể về nội dung cập nhật tại các Phụ lục của Hiệp định Mỹ phẩm ASEAN như sau:



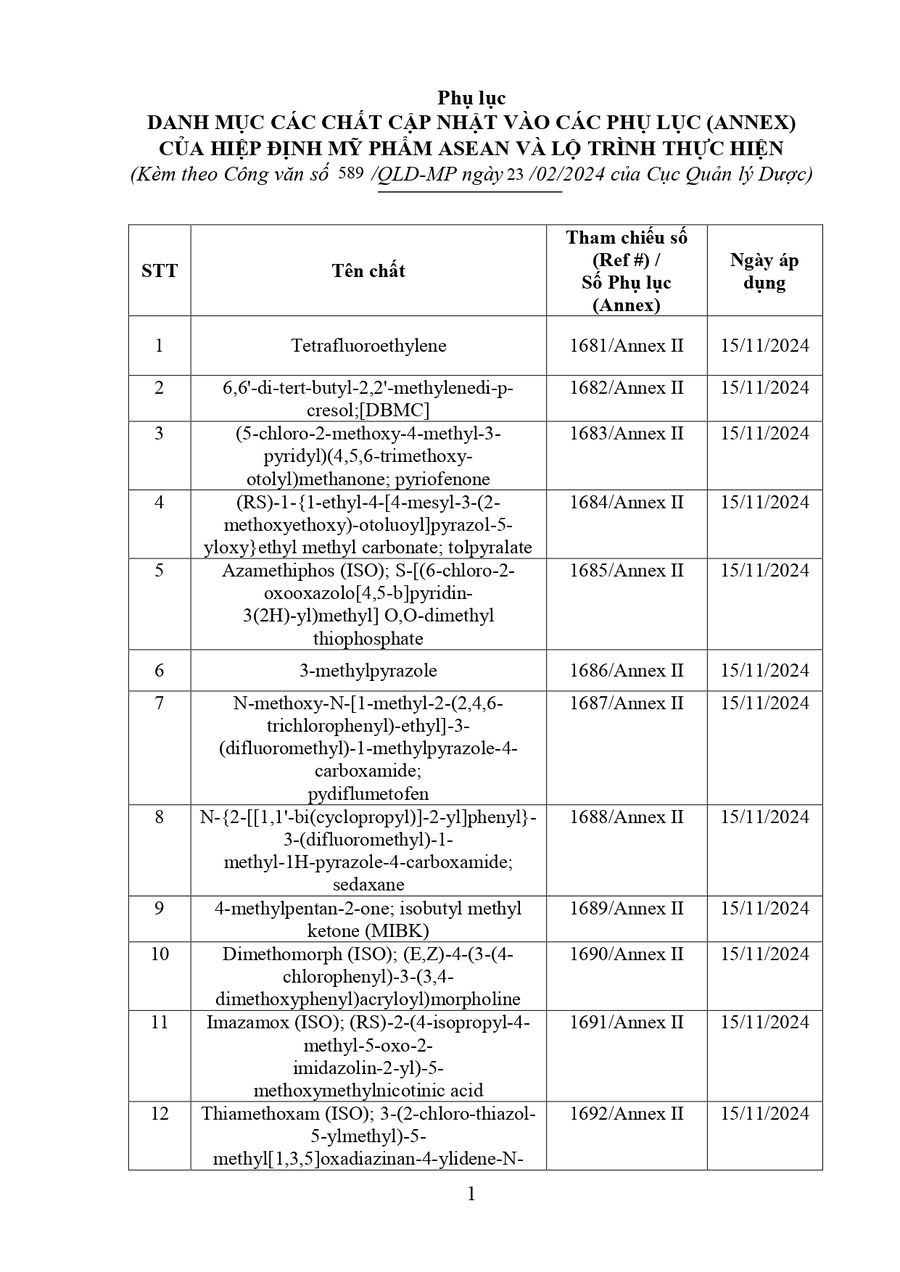
a) Tại Phụ lục II: Được bổ sung, sửa đổi như sau: - Bổ sung 14 chất (Tham chiếu số 1681, 1682, 1683, 1684, 1685, 1686, 1687, 1688, 1689, 1690, 1691, 1692, 1693, 1694).
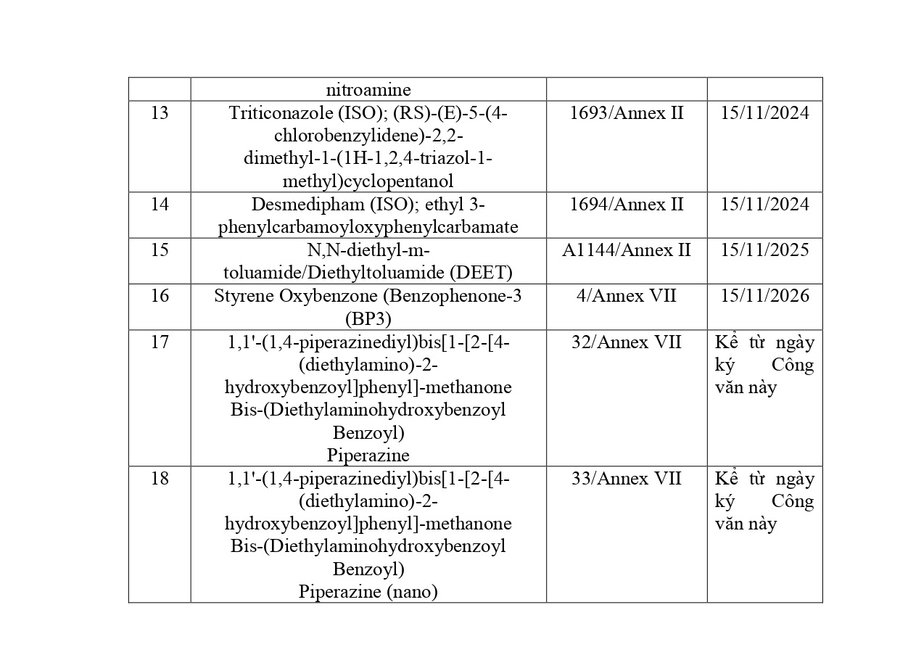
- Bổ sung chất N,N-diethyl-m-toluamide/Diethyltoluamide (DEET) vào Tham chiếu số A1144.
- Tham chiếu số 221: Bỏ dòng “ngoại trừ những trường hợp đặc biệt có trong Phụ lục VI” (except those special cases included in Annex VI).
- Tham chiếu số 1605, 1606, 1607: Sửa lỗi đánh máy trong đoạn sau: “ ... không phân biệt nguồn gốc, trong hỗn hợp được đưa ra thị trường có tỷ lệ = 0,1 % w/w” (... irrespective of the source, in the mixture as placed on the market is = 0.1 % w/w) thành “không phân biệt nguồn gốc, trong hỗn hợp được đưa ra thị trường có tỷ lệ ≥ 0,1 % w/w” (irrespective of the source, in the mixture as placed on the market is ≥ 0.1 % w/w).
b) Tại Phụ lục III: Được cập nhật, sửa đổi như sau:
- Tham chiếu số 12: Cột B (Chất / Số CAS): Bổ sung cụm từ “ngoại trừ các chất sau trong Phụ lục II: Tham chiếu số 1397, 1398, 1399” (with the exception of the following substances in Annex II: No. 1397, 1398, 1399) vào sau câu “Hydro peroxide và các hợp chất hoặc hỗn hợp khác giải phóng hydro peroxide, bao gồm carbamide peroxide và kẽm peroxide,” (Hydrogen peroxide, and other compounds or mixtures that release hydrogen peroxide, including carbamide peroxide and zinc peroxide,).
- Các tham chiếu số 324, 325, 327 và 339: Bỏ chú thích (22) ở cột B và bổ sung chú thích (22) ở cột E sau cụm từ “... tia UV nhân tạo” (... artificial UV light. (22)) thành “Đối với (a): Không được sử dụng trong các sản phẩm chống nắng và các sản phẩm tiếp xúc với tia UV tự nhiên hoặc nhân tạo. (22)” (For (a): Not to be used in sunscreen products and products marketed for exposure to natural / artificial UV light. (22)), (For (a): Not to be used in sunscreen products and products marketed for exposure to natural or artificial UV light. (22)).
c) Tại Phụ lục IV: Được cập nhật, sửa đổi như sau:
- Chất màu CI 45430: Cột “Các hạn chế và yêu cầu khác” (Other limitations and requirements): Bỏ chỉ tiêu kiểm soát tạp chất “Không quá 1% 2- (6-hydroxy-3-oxo-3H-xanthen-9-yl) axit benzoic và 2% 2-(bromo-6-hydroxy-3- oxo-3H-xanthen-9-yl) axit benzoic”.
d) Tại Phụ lục VI: Được cập nhật, sửa đổi như sau:
- Đoạn 5 của Lời mở đầu Phụ lục: Bỏ cụm từ “formaldehyde hoặc” do formaldehyde không là chất bảo quản được phép sử dụng.
- Tham chiếu số 31 (Methenamine 3-chloroallylochloride (INN) hay Quaternium-15): Được loại bỏ, do chất Quaternium-15 đã bị cấm sử dụng và đưa vào Phụ lục II Tham chiếu số 1386 của ACD.
đ) Tại Phụ lục VII: Được cập nhật, sửa đổi như sau:
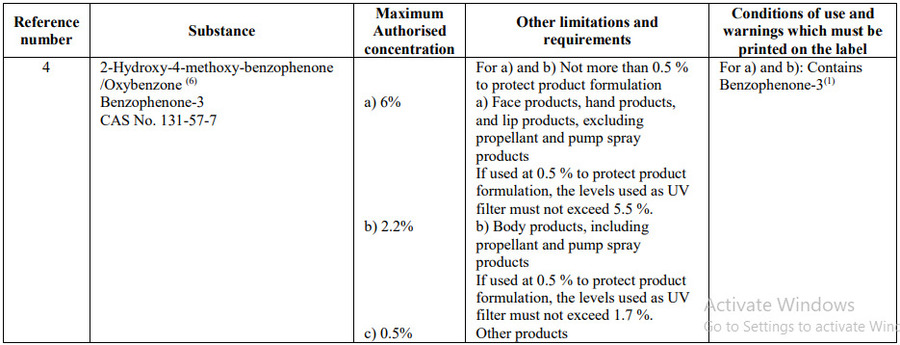
- Tham chiếu số 4: Sửa đổi quy định về việc sử dụng Benzophenone-3 là chất lọc tia tử ngoại như sau:
- Bổ sung 02 chất HAA299 (Bis-(Diethylaminohydroxybenzoyl Benzoyl) Piperazine) ở dạng không nano (Tham chiếu số 32), dạng nano (Tham chiếu số 33) và chú thích (7):
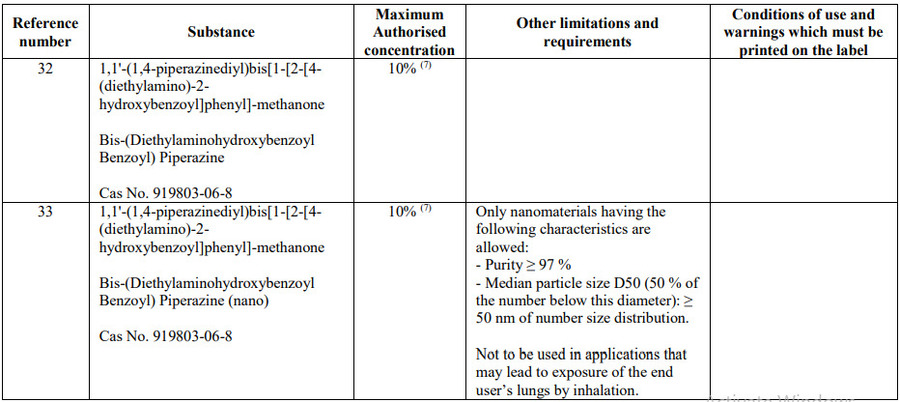
(7). Trường hợp sử dụng kết hợp Bis-(Diethylaminohydroxybenzoyl Benzoyl) Piperazine và Bis-(Diethylaminohydroxybenzoyl Benzoyl) Piperazine (nano), tổng tỉ lệ không được vượt quá 10%.
e) Lộ trình áp dụng: Kể từ ngày áp dụng nêu trong Phụ lục đính kèm Công văn này, chỉ các sản phẩm mỹ phẩm đáp ứng quy định mới được lưu hành trên thị trường, các sản phẩm mỹ phẩm không đáp ứng quy định sẽ bị thu hồi.
3. Đề nghị các cơ sở sản xuất, kinh doanh mỹ phẩm:
- Chủ động rà soát thành phần công thức sản phẩm mỹ phẩm được sản xuất, nhập khẩu, kinh doanh;
- Có kế hoạch sản xuất, nhập khẩu, kinh doanh phù hợp, bảo đảm sản phẩm mỹ phẩm đưa ra lưu hành đáp ứng quy định tại Thông tư số 06/2011/TTBYT ngày 25/01/2011 của Bộ trưởng Bộ Y tế quy định về quản lý mỹ phẩm, Hiệp định Mỹ phẩm ASEAN, các nội dung cập nhật Hiệp định Mỹ phẩm ASEAN được nêu tại Công văn này và các công văn cập nhật quy định về các chất dùng trong mỹ phẩm của Cục Quản lý Dược; tránh nguy cơ sản phẩm bị thu hồi, gây lãng phí.
4. Đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương phổ biến đến các đơn vị trên địa bàn biết và triển khai thực hiện các nội dung nêu tại mục 1, 2 và 3 Công văn này.
Thu Hằng
- Sản phẩm vì sức khỏe
-
Xác thực truy xuất nguồn gốc - 'thuốc đặc trị' chống hàng giả
Khi nền kinh tế số đang trở thành một trong những trụ cột phát triển của đất nước, thì yêu cầu về tính xác thực, minh bạch và khả năng truy xuất nguồn gốc của hàng hóa không chỉ phục vụ công tác quản lý nhà nước mà còn là điều kiện tiên quyết để nâng cao niềm tin thị trường trong nước và hội nhập quốc tế.July 9 at 8:25 am -
Công tác đánh giá, phân hạng sản phẩm OCOP được chia thành 02 cấp
Phó Thủ tướng Trần Hồng Hà ký Quyết định số 1489/QĐ-TTg ngày 6/7/2025 sửa đổi, bổ sung một số nội dung Quyết định số 148/QĐ-TTg về việc phê duyệt Bộ tiêu chí và quy trình đánh giá, phân hạng sản phẩm Chương trình mỗi xã một sản phẩm (OCOP).July 7 at 7:32 am -
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 3 at 12:01 pm -
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am




 Từ khóa:
Từ khóa: