Bộ Y tế tổ chức Hội thảo khoa học góp ý Luật sửa đổi, bổ sung một số điều của Luật Dược
Tham dự có PGS.TS. Lê Văn Truyền, nguyên Thứ trưởng Bộ Y tế, chuyên gia cao cấp dược học; đại diện Văn phòng Quốc hội, Văn phòng Chính phủ, Bộ Tư pháp, Bộ Công thương, Bộ Ngoại giao; một số Vụ, Cục, Viện, đơn vị thuộc và trực thuộc Bộ Y tế, Bảo hiểm xã hội Việt Nam, hiệp hội, doanh nghiệp kinh doanh trong lĩnh vực dược...
Hội thảo nhằm lắng nghe ý kiến bình luận từ các chuyên gia, nhà khoa học nhiều kinh nghiệm về xây dựng pháp luật, đánh giá thủ tục hành chính và các đối tượng chịu sự điều chỉnh của Luật Dược.

Thứ trưởng Bộ Y tế Đỗ Xuân Tuyên phát biểu
Phát biểu tại hội thảo, Thứ trưởng Bộ Y tế Đỗ Xuân Tuyên cho biết, Luật Dược số 105/2016/QH13 được Quốc hội thông qua ngày 06/4/2016 và có hiệu lực thi hành từ ngày 01/7/2017. Đến nay, sau 6 năm triển khai thi hành, Luật Dược cơ bản đã đáp ứng được yêu cầu thực tiễn của công tác quản lý nhà nước về dược, người dân cơ bản được sử dụng thuốc có chất lượng, an toàn và hiệu quả với giá cả phù hợp. Việc ban hành Luật Dược đã tạo điều kiện thuận lợi cho ngành Dược phát triển và hội nhập với các nước trong khu vực và trên thế giới. Tuy nhiên, sau 6 năm triển khai thi hành Luật, đặc biệt khi đại dịch COVID-19 bùng phát, Luật Dược bộc lộ một số khó khăn, bất cập, không còn phù hợp với tình hình thực tiễn và quá trình hội nhập quốc tế.
“Vì vậy, việc sửa đổi, bổ sung một số điều của Luật Dược để phù hợp với chủ trương, chính sách, đường lối của Đảng, Nhà nước và giải quyết những vấn đề vướng mắc phát sinh trong thực tiễn là rất cần thiết”- Thư trưởng nhấn mạnh.
Thứ trưởng Bộ Y tế cho biết thêm, ngày 02/6/2023, tại kỳ họp thứ 5, Quốc hội đã thông qua Chương trình xây dựng luật, pháp lệnh năm 2024, điều chỉnh chương trình xây dựng luật, pháp lệnh năm 2023, theo đó, dự án Luật sửa đổi, bổ sung một số điều của Luật Dược sẽ trình Quốc hội cho ý kiến vào kỳ họp thứ 7 (tháng 5/2024), trình Quốc hội thông qua vào kỳ họp thứ 8 (tháng 10/2024).
Hiện nay, Bộ Y tế đang tích cực xây dựng dự án Luật trên, cuối tháng 12 này sẽ gửi hồ sơ đề nghị Bộ Tư pháp thẩm định, tháng 02/2024 sẽ trình Chính phủ xin ý kiến. Để góp phần hoàn thiện dự thảo Luật Dược.
Mục tiêu sửa đổi, bổ sung Luật Dược nhằm khắc phục những bất cập, hạn chế của Luật đã được Quốc hội, Chính phủ tháo gỡ tại các Nghị quyết trong giai đoạn phòng, chống dịch COVID 19. Các Nghị quyết đã triển khai thực hiện có hiệu quả trong thực tiễn, cần thiết phải thể chế hoá vào trong Luật Dược. Bên cạnh đó, việc sửa đổi, bổ sung Luật Dược phải giải quyết được các vấn đề nảy sinh trong thực tiễn cần phải có cơ chế pháp lý điều chỉnh nhằm bảo đảm việc cung ứng thuốc kịp thời, có chất lượng, giá cả hợp lý đến người dân.
Thứ trưởng Bộ Y tế Đỗ Xuân Tuyên đề nghị, các đại biểu, các doanh nghiệp, các nhà khoa học, chuyên gia kinh tế, pháp lý và cơ quan quản lý chia sẻ một cách cởi mở, thẳng thắn các nội dung trong dự thảo Luật. Đồng thời, đưa ra các đề xuất phù hợp để góp ý hoàn thiện dự thảo Luật.
Thảo luận tại hội thảo, TS. Chu Thị Hoa, Phó Viện trưởng Viện Chiến lược và khoa học pháp lý, Bộ Tư pháp cho rằng dự thảo Luật Dược cơ bản đã thể chế hóa được các chủ trương của Đảng, chính sách của Nhà nước trong việc hoàn thiện pháp luật về dược đã nêu tại Nghị quyết số 20-NQ/TW ngày 25/10/2017 của Ban chấp hành Trung ương Đảng khóa XII về tăng cường công tác bảo vệ, chăm sóc và nâng cao sức khỏe nhân dân trong tình hình mới; Nghị quyết số 30/2021/QH15 ngày 28/7/2021 của Quốc hội, Nghị quyết 20/NQ-CP ngày 10/02/2022 của Chính phủ, Quyết định số 1661/QĐ-TTg ngày 04/10/2021, Quyết định số 1015/QĐ-TTg ngày 30/8/2022 của Thủ tướng Chính phủ....
Dự thảo Luật Dược cũng đã bảo đảm tính hợp hiến, thể chế hóa quyền cơ bản của công dân, trong đó có quyền “được bảo vệ, chăm sóc sức khỏe...” quy định tại Điều 38 Hiến pháp năm 2013. Bên cạnh đó, nội dung Dự thảo có liên quan đến một số luật hiện hành hoặc một số luật mới được sửa đổi gần đây như Luật Giá, Luật Đấu thầu, Luật Phí, lệ phí... Qua rà soát bước đầu cho thấy các quy định trong Dự thảo cơ bản không có điểm mâu thuẫn chồng chéo lớn với các luật trên, do đó về cơ bản đảm bảo tính thống nhất, đồng bộ. Những sửa đổi trong Dự thảo Luật Dược theo hướng đơn giản hoá thủ tục là tích cực đối với người dân và các doanh nghiệp kinh doanh dược phẩm tại Việt Nam.
Theo PGS.TS. Lê Văn Truyền, nguyên Thứ trưởng Bộ Y tế, chuyên gia cao cấp dược học, công nghiệp dược thế giới đã phát triển nhanh chóng từ đầu thế kỷ XXI. Nhiều công nghệ mới ra đời, nhiều thuốc mới ra đời. Cần xem xét bổ sung một số thuật ngữ mới trong phần định nghĩa. Cụ thể cần định nghĩa hoặc soát xét lại các thuật ngữ sau đây (theo WHO hoặc EMA, FDA).“Trên thực tế, trong mấy năm qua việc định nghĩa không chặt chẽ, chuẩn xác các khái niệm này đã tạo ra những bất cập, cách hiểu không thống nhất gây chậm trễ trong công tác đăng ký thuốc. Ví dụ: không thể đòi hỏi dữ liệu nghiên cứu lâm sàng theo bố cục bộ hồ sơ kỹ thuật chung ASEAN (ACTD) các thuốc được coi là bào chế, dược phẩm, y tế (grandfathered drug) vì những thuốc này đã có lịch sử lưu hành ở Việt Nam từ thập kỷ 60 thế kỷ trước nghĩa là cách nay gần nửa thế kỷ. Cơ quan Quản lý Thực phẩm và Thuốc Hoa Kỳ (FDA) Hoa Kỳ đã có những giải pháp cho các thuốc này bằng cách công bố một danh mục miễn trừ dựa trên đánh giá lợi ích-rủi ro”- PGS.TS. Lê Văn Truyền chia sẻ.

Quang cảnh hội thảo
Tại hội thảo các đại biểu cũng được nghe một số nội dung tham luận như: dự thảo Luật sửa đổi, bổ sung một số điều của Luật Dược; Bình luận một số nội dung liên quan đến thủ tục hành chính, hoạt động kinh doanh dược, điều kiện kinh doanh trong dự án Luật Dược; Nội dung quản lý nhà nước về lĩnh vực dược trong dự án Luật Dược; Đánh giá tính thống nhất của dự án Luật đối với hệ thống pháp luật Việt Nam.
Bảo Ngọc
- Sản phẩm vì sức khỏe
-
Xác thực truy xuất nguồn gốc - 'thuốc đặc trị' chống hàng giả
Khi nền kinh tế số đang trở thành một trong những trụ cột phát triển của đất nước, thì yêu cầu về tính xác thực, minh bạch và khả năng truy xuất nguồn gốc của hàng hóa không chỉ phục vụ công tác quản lý nhà nước mà còn là điều kiện tiên quyết để nâng cao niềm tin thị trường trong nước và hội nhập quốc tế.July 9 at 8:25 am -
Công tác đánh giá, phân hạng sản phẩm OCOP được chia thành 02 cấp
Phó Thủ tướng Trần Hồng Hà ký Quyết định số 1489/QĐ-TTg ngày 6/7/2025 sửa đổi, bổ sung một số nội dung Quyết định số 148/QĐ-TTg về việc phê duyệt Bộ tiêu chí và quy trình đánh giá, phân hạng sản phẩm Chương trình mỗi xã một sản phẩm (OCOP).July 7 at 7:32 am -
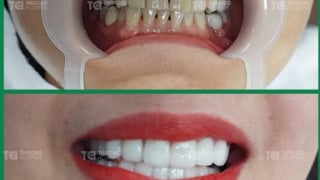
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 3 at 12:01 pm -
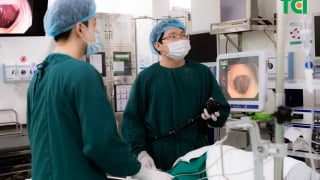
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am




 Từ khóa:
Từ khóa: