Alzheimer: Một loại thuốc mới được cơ quan châu Âu cấp phép
Ủy ban châu Âu đã thông báo vào 16/4/2025 rằng họ đã cho phép lưu hành một loại thuốc dùng để "điều trị rối loạn nhận thức nhẹ" ở một số bệnh nhân mắc bệnh Alzheimer. Lecanemab (tên thương mại là Leqembi) đã được Cơ quan Dược phẩm châu Âu (EMA) bật đèn xanh vào tháng 11 năm 2024. Được phát triển bởi phòng thí nghiệm dược phẩm Nhật Bản Eisai cùng với nhà sản xuất Mỹ Biogen, loại thuốc này đã được bán tại Hoa Kỳ từ đầu năm 2023, cũng như ở Trung Quốc, Nhật Bản và Vương quốc Anh.

(Ảnh minh họa)
Điểm đặc biệt của loại thuốc này là nó thuộc thế hệ điều trị mới nhắm đến một trong những nguyên nhân giả định của bệnh: các mảng amyloid. Đây là những cụm protein tích tụ trong các tế bào thần kinh và gây ra sự phá hủy của chúng. Các mảng này bị nghi ngờ là nguyên nhân dẫn đến các triệu chứng của bệnh. "Lecanemab cho thấy tác dụng rõ rệt lên các tổn thương não này, và lần đầu tiên, chúng ta có xác nhận rằng điều đó đi kèm với hiệu quả lên các triệu chứng", Bruno Dubois, Giáo sư danh dự ngành thần kinh học và thành viên Học viện Y học, gần đây chia sẻ với Le Figaro.
Kéo dài được vài tháng
Loại thuốc này – một kháng thể được tiêm tĩnh mạch hai tuần một lần – thực sự dường như làm chậm tiến trình các triệu chứng. Đó là kết quả từ một thử nghiệm lâm sàng được công bố vào cuối năm 2022 trên tạp chí khoa học danh tiếng New England Journal of Medicine. Sau một năm rưỡi điều trị, các bệnh nhân cải thiện triệu chứng nhận thức 27% so với những người dùng giả dược.
Tuy nhiên, ngoài chi phí cao (khoảng 25.000 euro mỗi bệnh nhân mỗi năm), lecanemab không phải là thuốc kỳ diệu. "Thuốc chỉ làm chậm việc chuyển sang các giai đoạn nặng hơn vài tháng, chứ không ngăn được sự tiến triển của bệnh", GS Bruno Dubois nhấn mạnh. Nói cách khác, nó giúp bệnh nhân có thêm thời gian. “Nếu chúng ta ước tính rằng kể từ khi chẩn đoán bị suy giảm nhẹ chức năng nhận thức, bệnh nhân trung bình còn khoảng 6 năm sống tự chủ, thì thuốc này có thể kéo dài thời gian đó thêm 19 tháng”, theo ước tính của Quỹ Alzheimer. Tuy nhiên, điều này vẫn mang tính giả thuyết: hiện chúng ta chỉ có dữ liệu theo dõi trong vòng 18 tháng. Khó có thể nói thuốc có hiệu quả ra sao sau thời gian đó.
Nguy cơ chảy máu não
Vào tháng 7 năm 2024, Cơ quan Dược phẩm châu Âu EMA (European Medicines Agency) ban đầu phản đối việc cho Leqembi lưu hành, với lý do rằng những lợi ích quan sát được không đủ lớn để bù lại các nguy cơ tác dụng phụ nghiêm trọng, đặc biệt là chảy máu não. Trong các thử nghiệm lâm sàng, những xuất huyết não nhỏ này đã xảy ra ở 14% bệnh nhân. Nguy cơ này đặc biệt cao ở một nhóm bệnh nhân mang đặc điểm di truyền nhất định. Gần đây, tại Hoa Kỳ, bảy người đã tử vong và ba người khác bị tàn tật nặng sau khi sử dụng loại thuốc này.
Sau quyết định đầu tiên đó của EMA, các công ty sản xuất đã kháng cáo và bổ sung thêm dữ liệu vào hồ sơ. Cơ quan này sau đó đã xem xét lại quyết định vào cuối năm ngoái, cho rằng “lợi ích của thuốc vượt trội so với rủi ro ở một nhóm bệnh nhân cụ thể”, theo thông cáo báo chí của Ủy ban châu Âu. Tuy nhiên, việc phân phối thuốc sẽ đi kèm với các điều kiện nghiêm ngặt. Chỉ những bệnh nhân có các mảng amyloid và chỉ mang một hoặc không mang bản sao nào của gen ApoE4 – tức là có nguy cơ chảy máu não thấp hơn – mới đủ điều kiện sử dụng thuốc.
Theo Figaro Santé
- Sản phẩm vì sức khỏe
-
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am -
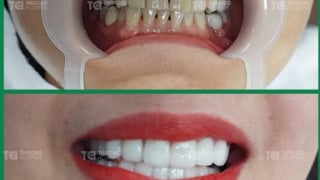
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 1 at 12:01 pm -
Chấm dứt ợ hơi, ợ chua, mất ngủ nhờ phương pháp đo áp lực thực quản HRM hiện đại
Từng khổ sở với ợ hơi, ợ chua, nuốt vướng và mất ngủ triền miên, chị H.T.B.L (38 tuổi) đã tìm lại giấc ngủ ngon và sức khỏe chỉ sau thời gian ngắn điều trị tại Bệnh viện Đa khoa Quốc tế Thu Cúc nhờ kỹ thuật đo áp lực và nhu động thực quản độ phân giải cao HRM.July 1 at 12:00 pm -
Long Châu hợp tác cùng Viện Kiểm nghiệm ATVSTP Quốc gia chủ động tiên phong tiến hành “kiểm tra kép vì sức khỏe người dân và khách hàng”
Trước thực trạng thuốc giả, thực phẩm chức năng giả làm ảnh hưởng nghiêm trọng đến niềm tin của người tiêu dùng và sức khỏe cộng đồng, hưởng ứng chủ trương của Chính phủ trong phòng chống hàng giả, hàng kém chất lượng, hệ thống nhà thuốc Long Châu chủ động tiên phong ký kết hợp tác chiến lược với Viện Kiểm nghiệm an toàn vệ sinh thực phẩm Quốc gia (Bộ Y tế).June 25 at 5:09 pm




 Từ khóa:
Từ khóa: