Bộ Y tế chưa thể cấp phép khẩn đối với vaccine COVID-19 Nanocovax
Công ty Nanogen cần bổ sung, cập nhật một số nội dung báo cáo Hội đồng Đạo đức và Hội đồng tư vấn tiếp tục xem xét, thẩm định.
Trong thời gian từ 8h đến 15h ngày 29/8, Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc cùng với Lãnh đạo các Vụ, Cục liên quan và đại diện Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia, các chuyên gia thẩm định thuộc các Tiểu ban đã họp xem xét hồ sơ đề nghị cấp giấy đăng ký lưu hành vaccine Nano Covax do Công ty cổ phần công nghệ sinh học dược Nanogen đăng ký và sản xuất.
Tại cuộc họp, sau khi nghe báo cáo của các tiểu ban chuyên môn thẩm định hồ sơ và kết luận của Hội đồng Đạo đức ngày 22/8, các thành viên Hội đồng tư vấn cấp Giấy đăng ký lưu hành thuốc và nguyên liệu làm thuốc (Hội đồng tư vấn) đã thảo luận và xem xét kỹ lưỡng các nội dung liên quan của hồ sơ đăng ký vaccine Nano Covax.
Tất cả các thành viên Hội đồng tư vấn đã thống nhất kết luận:
Bộ phận thường trực Hội đồng tư vấn và các đơn vị liên quan đã rất khẩn trương, sát sao hướng dẫn doanh nghiệp hoàn thiện hồ sơ trong thời gian sớm nhất theo đúng tinh thần cấp bách và quy trình cuốn chiếu. Hội đồng tư vấn đã nghiên cứu rất kỹ và xem xét một cách cẩn trọng hồ sơ. Hồ sơ đã được Tiểu ban Pháp chế thẩm định 2 lần, Tiểu ban Chất lượng thẩm định 4 lần, Tiểu ban Dược lý, Lâm sàng thẩm định 3 lần.
Các ý kiến thẩm định của các tiểu ban chuyên môn đối với hồ sơ pháp lý, chất lượng, dược lý, lâm sàng và kết luận của Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia (Hội đồng Đạo đức) là cơ sở để Hội đồng tư vấn thảo luận, xem xét việc cấp giấy đăng ký lưu hành vaccine Nano Covax.
Sau buổi họp, Hội đồng tư vấn ghi nhận các kết quả đạt được đối với hồ sơ đề nghị cấp giấy đăng ký lưu hành của vaccine NanoCovax đã được các tiểu ban chuyên môn thẩm định, Hội đồng Đạo đức nghiệm thu. Đồng thời, Hội đồng tư vấn đề nghị doanh nghiệp tiếp tục bổ sung, làm rõ các nội dung sau:
- Về hồ sơ chất lượng: Căn cứ kết quả thẩm định của tiểu ban chất lượng, đề nghị doanh nghiệp bổ sung, cập nhật một số nội dung theo ý kiến của tiểu ban chất lượng theo hình thức cuốn chiếu.
- Về hồ sơ dược lý, lâm sàng: Căn cứ kết quả thẩm định hồ sơ lâm sàng của Trung tâm Dược lý lâm sàng - Đại học Y Hà Nội và kết luận của Hội đồng Đạo đức ngày 22/8, Hội đồng tư vấn đề nghị:
- Về tính an toàn: Bổ sung, cập nhật thêm dữ liệu an toàn cho toàn bộ đối tượng đã được tiêm ít nhất một liều vaccine tới thời điểm hiện tại và giải thích rõ về các trường hợp sự cố bất lợi nghiêm trọng (SAE) tới thời điểm hiện tại.
- Về tính sinh miễn dịch: Bổ sung, cập nhật dữ liệu theo đề cương sửa đổi mới nhất được Hội đồng đạo đức thông qua, bao gồm đánh giá tính sinh miễn dịch trên các biến chủng mới (ví dụ biến chủng Delta, biến chủng Anh…) và cỡ mẫu đánh giá tính sinh miễn dịch cần thực hiện theo đúng đề cương nghiên cứu đã được thông qua.
- Về hiệu quả bảo vệ: Đề nghị doanh nghiệp phối hợp với nhóm nghiên cứu để phân tích, bàn luận về mối liên quan giữa tính sinh miễn dịch của vắc xin và hiệu quả bảo vệ tối thiểu 50% (theo hướng dẫn của Tổ chức Y tế thế giới - WHO) dựa trên các dữ liệu y văn.
Công ty cổ phần công nghệ sinh học dược Nanogen cần khẩn trương bổ sung, cập nhật các nội dung này, báo cáo Hội đồng Đạo đức và Hội đồng tư vấn tiếp tục xem xét, thẩm định cuốn chiếu các kết quả nghiên cứu để có thể cấp giấy đăng ký lưu hành có điều kiện trong trường hợp cấp bách.
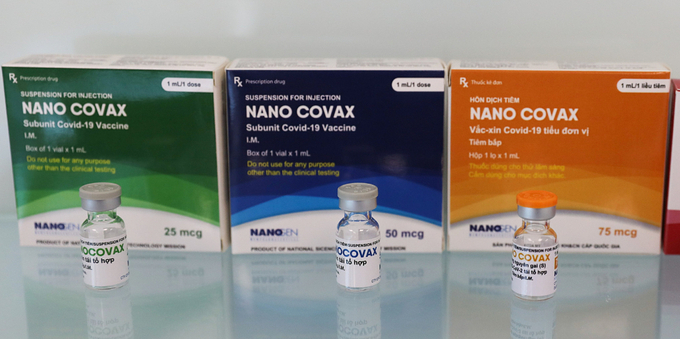
Vaccine NanoCovax sử dụng công nghệ protein tái tổ hợp, là vaccine ngừa COVID-19 đầu tiên của Việt Nam thử nghiệm lâm sàng
Trước đó, trong các ngày 20-22/8, Hội đồng Đạo đức đã họp thẩm định, chấp thuận kết quả giữa kỳ pha 3a vaccine Nano Covax, sau đó tư vấn, chuyển hồ sơ sang Hội đồng Cấp phép để xem xét. Đây là cơ sở, điều kiện cần đầu tiên cho quá trình cấp phép khẩn cấp một loại vaccine, sinh phẩm y tế.
Phía Hội đồng Đạo đức cho biết việc chấp thuận kết quả giữa kỳ 3a dựa trên các dữ liệu báo cáo đến ngày 20/8. Tuy nhiên việc cấp phép hay không phụ thuộc hoàn toàn vào quyết định của Hội đồng Cấp phép. Hội đồng Đạo đức chỉ là bên đưa ra ý kiến tư vấn.
Vaccine Nano Covax sử dụng công nghệ protein tái tổ hợp, là vaccine ngừa COVID-19 đầu tiên của Việt Nam thử nghiệm lâm sàng, bắt đầu từ ngày 17/12/2020.
Vào đầu tháng 8 vừa qua, một số tỉnh có văn bản gửi Bộ Y tế xin tham gia thử nghiệm vaccine Nano Covax với số lượng hàng trăm nghìn người.
Tuy nhiên, Bộ Y tế chưa đồng ý vì cho rằng thử nghiệm cần phải đúng quy trình, tuân theo đề cương nghiên cứu và phải được Hội đồng Đạo đức phê duyệt.
Ngoài Nano Covax, 2 ứng viên vaccine ngừa COVID-19 khác cũng đang thử nghiệm lâm sàng là vaccine Covivac của IVAC đang thử nghiệm giai đoạn 2 và vaccine ARCT-154 được Mỹ chuyển giao công nghệ đang thử nghiệm pha 1.
Lương Huyền
- Sản phẩm vì sức khỏe
-
Xác thực truy xuất nguồn gốc - 'thuốc đặc trị' chống hàng giả
Khi nền kinh tế số đang trở thành một trong những trụ cột phát triển của đất nước, thì yêu cầu về tính xác thực, minh bạch và khả năng truy xuất nguồn gốc của hàng hóa không chỉ phục vụ công tác quản lý nhà nước mà còn là điều kiện tiên quyết để nâng cao niềm tin thị trường trong nước và hội nhập quốc tế.July 9 at 8:25 am -
Công tác đánh giá, phân hạng sản phẩm OCOP được chia thành 02 cấp
Phó Thủ tướng Trần Hồng Hà ký Quyết định số 1489/QĐ-TTg ngày 6/7/2025 sửa đổi, bổ sung một số nội dung Quyết định số 148/QĐ-TTg về việc phê duyệt Bộ tiêu chí và quy trình đánh giá, phân hạng sản phẩm Chương trình mỗi xã một sản phẩm (OCOP).July 7 at 7:32 am -
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 3 at 12:01 pm -
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am




 Từ khóa:
Từ khóa: