Thu hồi thêm 8 loại thuốc tim mạch chứa nguyên liệu có thể gây ung thư
Ngày 6/9, Cục Quản lý Dược cho biết đã ra quyết định thu hồi thêm 8 loại thuốc có hoạt chất Valsartan trị huyết áp, tim mạch do sử dụng nguyên liệu bị nhiễm tạp chất gây ung thư.
Ông Đỗ Văn Đông – Phó Cục trưởng Cục Quản lý Dược - cho biết, đây là quyết định căn cứ theo thông báo của Cơ quan Quản lý Dược phẩm châu Âu (EMA), Cơ quan Quản lý Dược Mỹ, Cơ quan quản lý Dược Đài Loan (Trung Quốc) và một số cơ quan quản lý dược khác trên thế giới công bố thêm về các nhà sản xuất nguyên liệu Valsartan chứa tạp chất N-nitrosodimethylamine (NDMA) là Công ty Zhuhai Rundu Pharmaceutical Co, Ltd và Công ty Hetero Labs Ltd.
Cục Quản lý Dược yêu cầu các doanh nghiệp đang phân phối thuốc chứa Valsartan bị đình chỉ lưu hành, thu hồi nêu trên khẩn trương thu hồi toàn bộ số thuốc và báo cáo kết quả về Cục trước ngày 30/9.

Như vậy, tính đến thời điểm này, đã có 39 loại thuốc trong nước và 15 loại thuốc thành phẩm từ nước ngoài chứa hoạt chất Valsartan bị đình chỉ lưu hành và thu hồi do sử dụng nguyên liệu chứa tạp chất có thể gây ung thư.
Bên cạnh đó, có 83 loại thuốc chứa hoạt chất Valsartan không sử dụng nguyên liệu của các công ty nói trên sẽ tiếp tục được nhập khẩu, sản xuất, lưu hành.
Trước đó, Cục Quản lý Dược, Bộ Y tế cho biết vừa có văn bản hỏa tốc gửi Sở Y tế các tỉnh/thành, các cơ sở kinh doanh thuốc về việc đình chỉ 23 loại thuốc thành phẩm được sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical – Trung Quốc sản xuất.
Nguyên liệu Valsartan bị Cơ quan Quản lý Dược phẩm châu Âu (EMA), Cơ quan Quản lý Dược Canada và một số cơ quan quản lý dược khác đã cảnh báo loại thuốc này có chứa tạp chất N-nitrosodimethylamine (NDMA) có nguy cơ gây ung thư và yêu cầu thu hồi sản phẩm.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược yêu cầu ngừng ngay việc sử dụng nguyên liệu này để sản xuất thuốc thành phẩm; thực hiện đánh giá nhà cung cấp. Đồng thời, cơ quan chức năng kiểm tra, nghiên cứu sử dụng nguyên liệu Valsartan của nhà sản xuất mới nhằm đảm bảo yêu cầu về chất lượng, an toàn cho người sử dụng và thực hiện thủ tục thay đổi hồ sơ đăng ký thuốc theo đúng quy định của pháp luật.
Valsartan là nguyên liệu thuốc được sử dụng để điều trị bệnh tăng huyết áp, suy tim, ngăn ngừa đột quỵ, nhồi máu cơ tim và các vấn đề về thận…
Cục Quản lý Dược bổ sung thêm các loại thuốc bị thu hồi là: Valsartan160, SĐK: VD-29714-18 (Công ty cổ phần Dược phẩm Cửu Long), Cobidan 80, SĐK: VD-22086-15 (Công ty cổ phần BV Pharma), các thuốc Meyervasid M, SĐK: VD-30052-18; Mayervas 160, SĐK: VD-26480-17; Mayervas 80, SĐK: VD-26481-17; Mayervasid, SĐK: VD-26482-17; Meyervasid F, SĐK: VD-26483-17 (Công ty Liên doanh Meyer-BPC) và thuốc Valthotan F11m Coated Tablets 160mg Standard, SĐK:VN-17592-13 (Standard Chem & Pharm Co., Ltd).
- Sản phẩm vì sức khỏe
-
Xác thực truy xuất nguồn gốc - 'thuốc đặc trị' chống hàng giả
Khi nền kinh tế số đang trở thành một trong những trụ cột phát triển của đất nước, thì yêu cầu về tính xác thực, minh bạch và khả năng truy xuất nguồn gốc của hàng hóa không chỉ phục vụ công tác quản lý nhà nước mà còn là điều kiện tiên quyết để nâng cao niềm tin thị trường trong nước và hội nhập quốc tế.July 9 at 8:25 am -
Công tác đánh giá, phân hạng sản phẩm OCOP được chia thành 02 cấp
Phó Thủ tướng Trần Hồng Hà ký Quyết định số 1489/QĐ-TTg ngày 6/7/2025 sửa đổi, bổ sung một số nội dung Quyết định số 148/QĐ-TTg về việc phê duyệt Bộ tiêu chí và quy trình đánh giá, phân hạng sản phẩm Chương trình mỗi xã một sản phẩm (OCOP).July 7 at 7:32 am -
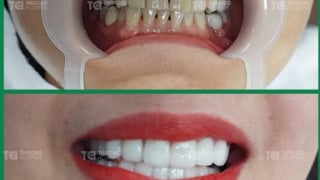
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 3 at 12:01 pm -
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am




 Từ khóa:
Từ khóa: