Thu hồi thuốc Viên nang cứng Reinal-5 (Flunarizin 5mg) vi phạm mức độ 2
Căn cứ vào các quy định về quản lý dược hiện hành của Việt Nam. Căn cứ Công văn số 840/VKNT-KHTH ngày 10/09/2024 của Viện Kiểm nghiệm thuốc Tp. Hồ Chí Minh gửi kèm phiếu kiểm nghiệm số 0160/VKNKT2024 ngày 10/09/2024 về thuốc Viên nang cứng Reinal-5 (Flunarizin 5mg), Số GĐKLH: VD-30346-18, Số lô: 240256; NSX: 20/02/2024; HD: 20/02/2027 do Công ty cổ phần dược phẩm Đạt Vi Phú sản xuất. Mẫu thuốc do Viện Kiểm nghiệm thuốc TP. Hồ Chí Minh lấy tại Công ty cổ phần dược phẩm Đạt Vi Phú (Lô M7A, đường D17, khu công nghiệp Mỹ Phước 1, phường Thới Hòa, thị xã Bến Cát, tỉnh Bình Dương). Mẫu thuốc không đạt tiêu chuẩn chất lượng về chỉ tiêu Độ hòa tan (vi phạm mức độ 2).
Cục Quản lý Dược thông báo:


1. Thu hồi toàn quốc Viên nang cứng Reinal-5 (Flunarizin 5mg), Số GĐKLH: VD-30346-18, Số lô: 240256; NSX: 20/02/2024; HD: 20/02/2027 do Công ty cổ phần dược phẩm Đạt Vi Phú sản xuất.
2. Công ty cổ phần dược phẩm Đạt Vi Phú phối hợp với nhà phân phối thuốc, phải:
+ Trong thời hạn 2 ngày kể từ ngày ký Công văn này, gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng Viên nang cứng Reinal-5 (Flunarizin 5mg), Số GĐKLH: VD-30346-18, Số lô: 240256; NSX: 20/02/2024; HD: 20/02/2027 do Công ty cổ phần dược phẩm Đạt Vi Phú sản xuất và tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nêu trên.
+ Gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 18 ngày kể từ ngày ký Công văn này, hồ sơ thu hồi bao gồm số lượng sản xuất, số lượng phân phối, ngày sản xuất, số lượng thu hồi, các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định tại Thông tư số 11/2018/TT-BYT ngày 04/05/2018 của Bộ Y tế quy định về chất lượng thuốc, nguyên liệu làm thuốc.
3. Sở Y tế các tỉnh thành phố trực thuộc Trung ương, Y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc không đạt chất lượng nêu trên, công bố thông tin về quyết định thu hồi thuốc trên Trang thông tin điện tử của Sở, kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đơn vị vi phạm theo quy định hiện hành; báo cáo về Cục Quản lý Dược và các cơ quan chức năng có liên quan.
4. Sở Y tế tỉnh Bình Dương kiểm tra và giám sát Công ty cổ phần dược phẩm Đạt Vi Phú thực hiện việc thu hồi và xử lý thuốc bị thu hồi theo quy định. Cục Quản lý Dược thông báo để các đơn vị biết và thực hiện.
Thu Hằng
- Sản phẩm vì sức khỏe
-
Xác thực truy xuất nguồn gốc - 'thuốc đặc trị' chống hàng giả
Khi nền kinh tế số đang trở thành một trong những trụ cột phát triển của đất nước, thì yêu cầu về tính xác thực, minh bạch và khả năng truy xuất nguồn gốc của hàng hóa không chỉ phục vụ công tác quản lý nhà nước mà còn là điều kiện tiên quyết để nâng cao niềm tin thị trường trong nước và hội nhập quốc tế.July 9 at 8:25 am -
Công tác đánh giá, phân hạng sản phẩm OCOP được chia thành 02 cấp
Phó Thủ tướng Trần Hồng Hà ký Quyết định số 1489/QĐ-TTg ngày 6/7/2025 sửa đổi, bổ sung một số nội dung Quyết định số 148/QĐ-TTg về việc phê duyệt Bộ tiêu chí và quy trình đánh giá, phân hạng sản phẩm Chương trình mỗi xã một sản phẩm (OCOP).July 7 at 7:32 am -
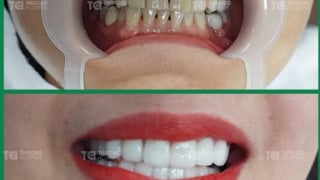
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 3 at 12:01 pm -
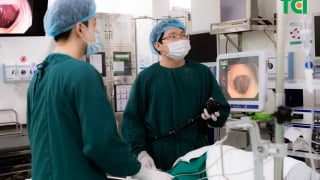
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am




 Từ khóa:
Từ khóa: