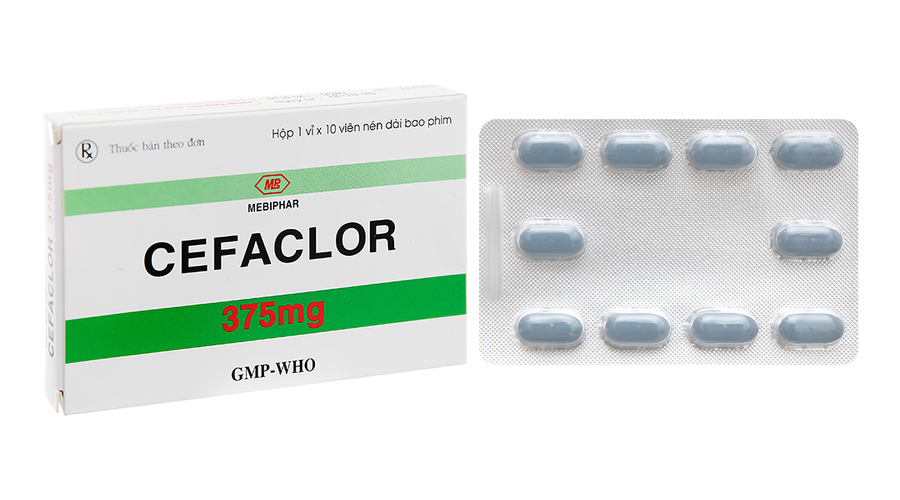
Thu hồi thuốc Viên nén dài bao phim Cefaclor 375mg vi phạm mức độ 2
Căn cứ vào các quy định về quản lý dược hiện hành của Việt Nam.
Căn cứ Công văn số 727/VKNT-KHTH ngày 8/8/2024 của Viện Kiểm nghiệm thuốc TP. Hồ Chí Minh gửi kèm phiếu kiểm nghiệm số 0220/VKN-KT2024 ngày 8/8/2024 về thuốc Viên nén dài bao phim Cefaclor 375mg (Cefaclor), Số GĐKLH: VD-14047-11, Số lô: 0124 NSX: 23/01/24 HD: 23/01/27 do Chi nhánh Công ty cổ phần Dược phẩm và sinh học y tế sản xuất. Mẫu thuốc do Viện Kiểm nghiệm thuốc TP. Hồ Chí Minh lấy tại Chi nhánh Công ty cổ phần dược phẩm và sinh học y tế (địa chỉ: Lô III - 18 đường số 13, Khu công nghiệp Tân Bình, Quận Tân Phú, TP. Hồ Chí Minh). Mẫu thuốc không đạt tiêu chuẩn chất lượng về chỉ tiêu Độ hòa tan (vi phạm mức độ 2).
Ngày 9/8/2024, Cục Quản lý Dược nhận được văn thư số 148/DPSH/2024 đề ngày 3/8/2024 của Công ty cổ phần Dược phẩm và sinh học y tế về việc đề nghị tự nguyện thu hồi lô thuốc Viên nén dài bao phim Cefaclor 375mg (Cefaclor), Số GĐKLH: VD-14047-11, Số lô: 0124 NSX: 23/01/24 HD: 23/01/27 do Chi nhánh Công ty cổ phần dược phẩm và sinh học y tế sản xuất.
Cục Quản lý Dược thông báo:


1. Thu hồi toàn quốc Viên nén dài bao phim Cefaclor 375mg (Cefaclor), Số GĐKLH: VD-14047-11, Số lô: 0124 NSX: 23/01/24 HD: 23/01/27 do Chi nhánh Công ty cổ phần dược phẩm và sinh học y tế sản xuất.
2. Chi nhánh Công ty cổ phần dược phẩm và sinh học y tế phối hợp với nhà phân phối thuốc, phải:
+ Trong thời hạn 2 ngày kể từ ngày ký Công văn này, gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng Viên nén dài bao phim Cefaclor 375mg (Cefaclor), Số GĐKLH: VD-14047-11, Số lô: 0124 NSX: 23/01/24 HD: 23/01/27 do Chi nhánh Công ty cổ phần Dược phẩm và sinh học y tế sản xuất và tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nêu trên.
+ Gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 18 ngày kể từ ngày ký Công văn này, hồ sơ thu hồi bao gồm số lượng sản xuất, số lượng phân phối, ngày sản xuất, số lượng thu hồi, các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định tại Thông tư số 11/2018/TT-BYT ngày 04/05/2018 của Bộ Y tế quy định về chất lượng thuốc, nguyên liệu làm thuốc.
3. Sở Y tế các tỉnh thành phố trực thuộc Trung ương, Y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc không đạt chất lượng nêu trên, công bố thông tin về quyết định thu hồi thuốc trên Trang thông tin điện tử của Sở, kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đơn vị vi phạm theo quy định hiện hành; báo cáo về Cục Quản lý Dược và các cơ quan chức năng có liên quan.
4. Sở Y tế TP. Hồ Chí Minh kiểm tra và giám sát Chi nhánh Công ty cổ phần dược phẩm và sinh học y tế thực hiện việc thu hồi và xử lý thuốc bị thu hồi theo quy định. Cục Quản lý Dược thông báo để các đơn vị biết và thực hiện.
Thu Hằng
- Sản phẩm vì sức khỏe
-
Đau họng, ợ hơi, tức ngực: Người đàn ông ngỡ ngàng phát hiện ung thư đại tràng sớm qua nội soi
Người đàn ông 37 tuổi khỏe mạnh bàng hoàng phát hiện có tổn thương nguy cơ ung thư nhờ công nghệ nội soi hiện đại tại Bệnh viện Thu Cúc. Câu chuyện của anh là hồi chuông cảnh tỉnh cho nhiều người trẻ còn đang chủ quan, thờ ơ với sức khỏe tiêu hóa.July 2 at 10:13 am -
Lấy lại nụ cười tự tin với dịch vụ bọc răng sứ tại TCI
Hàng nghìn khách hàng đã tìm lại nụ cười tự tin nhờ dịch vụ bọc răng sứ tại Khoa Răng Hàm Mặt bệnh viện Đa khoa Quốc tế (ĐKQT) Thu Cúc TCI.July 1 at 12:01 pm -
Chấm dứt ợ hơi, ợ chua, mất ngủ nhờ phương pháp đo áp lực thực quản HRM hiện đại
Từng khổ sở với ợ hơi, ợ chua, nuốt vướng và mất ngủ triền miên, chị H.T.B.L (38 tuổi) đã tìm lại giấc ngủ ngon và sức khỏe chỉ sau thời gian ngắn điều trị tại Bệnh viện Đa khoa Quốc tế Thu Cúc nhờ kỹ thuật đo áp lực và nhu động thực quản độ phân giải cao HRM.July 1 at 12:00 pm -
Long Châu hợp tác cùng Viện Kiểm nghiệm ATVSTP Quốc gia chủ động tiên phong tiến hành “kiểm tra kép vì sức khỏe người dân và khách hàng”
Trước thực trạng thuốc giả, thực phẩm chức năng giả làm ảnh hưởng nghiêm trọng đến niềm tin của người tiêu dùng và sức khỏe cộng đồng, hưởng ứng chủ trương của Chính phủ trong phòng chống hàng giả, hàng kém chất lượng, hệ thống nhà thuốc Long Châu chủ động tiên phong ký kết hợp tác chiến lược với Viện Kiểm nghiệm an toàn vệ sinh thực phẩm Quốc gia (Bộ Y tế).June 25 at 5:09 pm




 Từ khóa:
Từ khóa: